3.2. Nemetālu iegūšana un ķīmiskās īpašības
Nemetāli dabā ir sastopami gan brīvā veidā (cēlgāzes, skābeklis, sērs, slāpeklis, ogleklis), gan savienojumu veidā, piemēram: SiO2
– kvarcs, Ca3(PO4)2 – fosforīti, apatīti, FeS2 – pirīts, NaCl - akmeņsāls (halīts).
Nemetālu iegūšanas metodes
3. tabula
Fizikālās
metodes
|
Sašķidrinot gaisu:
O2,
N2, Ar
|
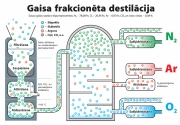 Palielināt.
Palielināt.
|
Ķīmiskās
metodes
|
a) Ūdeņraža iegūšana
Zn + 2HCl → ZnCl2
+ H2
b) Skābekļa iegūšana
2KMnO4 K2MnO4
+ MnO2 + O2
K2MnO4
+ MnO2 + O2
c) Hlora iegūšana
2KMnO4 + 16HCl→
2MnCl2 + 5Cl2 + 2KCl + 8H2O
|

Filma

Filma

Filma
|
Elektroķīmiskās
metodes
|
a) Ūdeņraža un skābekļa iegūšana no ūdens.
Iegūst izmantojot Hofmaņa aparātu
2H2O  2H2 + O2 2H2 + O2
b) Halogēnu iegūšana elektrolizējot sāļu kausējumus vai ūdensšķīdumus
2NaCl  2Na + Cl2
2Na + Cl2 |

Animācija:
 |
Nemetālu ķīmiskās īpašības
Nemetāliem piemīt gan oksidējošas, gan reducējošas
īpašības.
Piemēram, sērs reakcijā ar cinku Zn darbojas kā oksidētājs, bet reakcijā ar skābekli O2
– kā reducētājs.



|

Filma |



|

Filma
|
| Hlors reakcijā ar metālu bromīdiem un jodīdiem darbojas kā oksidētājs.
|
|



|

Filma |
| Hlora oksidējošās īpašības izmanto audumu un papīra balināšanā.
|

Filma
|