1.2. Ogļūdeņražu hidroksilatvasinājumu īpašības
Spirtu fizikālās īpašības.
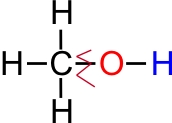
• Daļa spirtu šķīst ūdenī (daži jaucas ar ūdeni jebkurās attiecībās). Šo īpašību cēlonis ir spirtu molekulu polārā uzbūve.
• Starp spirtu skābekļa atomiem un hidroksilgrupas
ūdeņraža atomiem veidojas ūdeņražsaite.
Animācija.
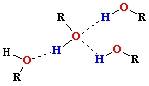
ar H-O-R ir apzīmētas spirta molekulas, kur R ir ogļūdeņražu atlikumu virkne
|
Tāda pati saite veidojas arī spirtu ūdensšķīdumos.
Animācija.
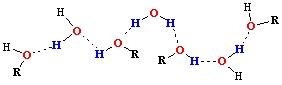
Ar H-O-H ir apzīmētas ūdens molekulas,
bet ar H-O-R ir apzīmētas spirta molekulas, kur R ir ogļūdeņražu atlikumu virkne
|
Šķīdinot spirtu ūdenī, novēro šķiduma kopējā tilpuma samazināšanos. Piemēram, istabas temperatūrā sajaucot 50 ml ūdens ar 50 ml spirta, iegūst nevis 100 ml, bet gan tikai 96 ml šķīduma.
Ja spirta alkilgrupa satur lielu oglekļa atomu skaitu, ūdeņražsaites veidošanos apgrūtina alkilgrupu atgrūšanās spēki.
Šķidrumam iztvaikojot, ūdeņražsaites pārtrūkst. Lai spirta viršanas temperatūrā molekulas brīvi izdalītos no šķidruma, papildus jāpārrauj arī ūdeņražsaites. Šim procesam nepieciešama enerģija, tāpēc arī viršana notiek augstākā temperatūrā nekā alkāniem.
Palielināt.
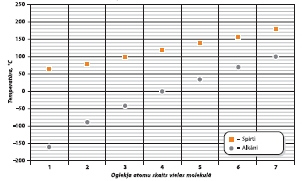 1. att. Vienvērtīgo piesātināto spirtu un alkānu viršanas
1. att. Vienvērtīgo piesātināto spirtu un alkānu viršanas
temperatūras atkarība no oglekļa atomu skaita.
Pieaugot spirta molekulmasai, to šķīdība ūdenī samazinās. Jo lielāka alkilgrupa, jo mazāka ūdeņražsaišu veidošanās iespēja. Alkanoli ar nelielu alkilgrupu labi šķīst ūdenī.
Filma
 Vienvērtīgo piesātināto spirtu šķīdība ūdenī
Vienvērtīgo piesātināto spirtu šķīdība ūdenī
3. tabula
| Spirta formula
|
Šķīdība,
g /100g H2O
|
|
CH3OH
|
∞
|
|
C2H5OH
|
∞
|
|
C3H7OH
|
∞
|
|
C4H9OH
|
9 |
|
C5H11OH
|
2,7 |
|
C6H13OH
|
0,59 |
|
C7H15OH
|
0,09 |
|
C8H17OH
|
0 |
|
C9H19OH
|
0 |
Spirtu ķīmiskās īpašības.
Spirtu reakcijas var iedalīt divās grupās:
a) reakcijas, kurās pārtrūkst O —
H saite
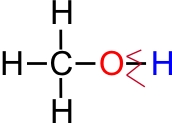
b) reakcijas kurās pārtrūkst saite C — OH (hidroksilgrupas atšķelšana).
 Spirtu ķīmiskās īpašības
Spirtu ķīmiskās īpašības
4. tabula
|
Ķīmiskās reakcijas
|
Vienvērtīgie piesātinātie spirti
|
Daudzvērtīgie spirti
|
|
Aizvietošanās |
vienādojums
 |
vienādojums
 |
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
2C3H5(OH)3
+ 6Na → 2C3H5(ONa)3
+3H2
|
Oksidēšanās |
vienādojums
vienādojums


 |
vienādojums
 |
C2H5OH+3O2→ 2CO2+
3H2O
2C2H4(OH)2
+5O2→ 4CO2+ 6H2O
|
|
Dehidratācijas |
vienādojums
vienādojums
 |
|
CH 3─ CH 2OH
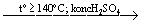 CH 2═ CH 2 + H 2O
2C 2H 5OH
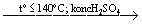 C 2H 5OC 2H 5 + H 2O |
|
ar slāpekļskābi |
|
vienādojums
|
|
C3H5(OH)3
+ 3HNO3 → C3H5(ONO2)3 +3H2O
|
|
ar Cu(OH)2 |
|
vienādojums
 |
|
C3H5(OH)3
+ Cu(OH)2 →C3H5(OH)O2Cu + 2H2O
|
Fenola ķīmiskās īpašības.
5. tabula
 Uzklikšķinot uz nosaukumiem, atveras attēls.
Uzklikšķinot uz nosaukumiem, atveras attēls.
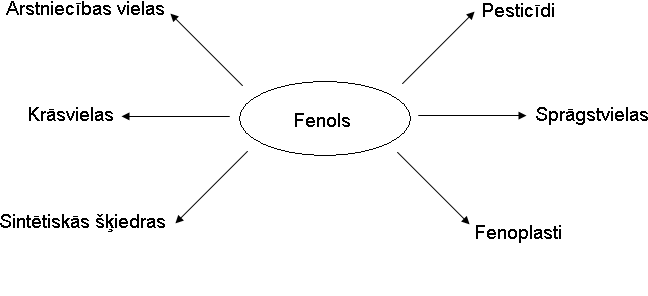 Uzklikšķinot uz nosaukumiem, atveras attēls.
Uzklikšķinot uz nosaukumiem, atveras attēls.